Image : Adobe Firefly
Introduction
Le chlore porte le symbole Cl et le numéro atomique 17. Son nom vient du grec « khlôros », qui signifie « vert pâle » — la couleur du dichlore gazeux (Cl₂), décrit dès 1774 par Carl Wilhelm Scheele. Le chlore est extrêmement réactif ; il n’existe pas seul dans la nature, mais uniquement allié à d’autres éléments pour former des composés stables.
Cette série présente les éléments du Tableau périodique des éléments chimiques. Ce répertoire, conçu vers 1869 par Dmitri Ivanovich Mendeleïev, rassemble tous les éléments chimiques, qui composent l’univers, tel que nous le connaissons aujourd’hui. L’ingéniosité de ce Tableau tient dans la méthode de répartition des éléments, selon leur numéro atomique, mais aussi selon leurs caractéristiques physiques et chimiques. Ce classement astucieux permet alors d’identifier des éléments existants qui restaient à découvrir, ou même de prédire les propriétés d’éléments chimiques inconnus à l’époque. Sa dernière mise à jour date de 2016, et compte 118 éléments.
Sur Terre, le chlore représente 0,014 5 % de la croûte terrestre. On le trouve principalement dans le sel gemme — ces cristaux de chlorure de sodium formés par l’évaporation d’anciennes mers. La mer Morte en est un exemple connu : elle contient environ 9 fois plus de chlore que les océans ordinaires, sous forme de chlorure de magnésium et de chlorure de sodium — ainsi que de nombreux autres minéraux, ce qui lui confère sa salinité exceptionnelle, et qui rend son eau si dense que les baigneurs y flottent sans effort.
De l’eau potable à la médecine, en passant par l’industrie chimique ou notre pharmacie, le chlore est présent partout dans notre quotidien.
Le chlore au passé
— Le chlore, première arme chimique
Le 22 avril 1915, au nord d’Ypres (Belgique), advient la première utilisation à grande échelle de gaz toxique sur un champ de bataille moderne. Stockées dans des milliers de bonbonnes, environ 150 tonnes de chlore sont réparties sur un front d’environ 6 km par l’armée allemande. Un nuage verdâtre, porté par un vent favorable, envahit les tranchées françaises. Privés de protection adéquate, les soldats suffoquent. Les archives alliées mentionnent 1 000 morts et 15 000 blessés graves.
Cette attaque, orchestrée par le chimiste allemand Fritz Haber, marque l’avènement de la guerre chimique. – Petit aparté : ironiquement, ce même scientifique recevra en 1918 le prix Nobel de chimie pour ses ouvrages sur la synthèse de l’ammoniac, pivot de la fabrication d’explosifs et d’engrais. Pour illustrer l’importance de ces travaux, on estimait (en 2010) qu’un tiers de la production alimentaire mondiale annuelle utilisait de l’ammoniac issu du procédé Haber–Bosch et que cette production nourrissait près de la moitié de la population mondiale.
La réaction des Alliés est rapide. Ils développent des masques à gaz de plus en plus sophistiqués et ripostent avec leurs propres armes chimiques. L’escalade est lancée : le chlore sera suivi du phosgène, puis du gaz moutarde, tristement célèbre. À la fin de la Grande Guerre, les armes chimiques auront causé environ 90 000 décès et plus de 1 million de blessés graves ou aux prises avec des souffrances endémiques de part et d’autre du conflit, dont 12 000 Canadiens. Plusieurs ne signalèrent pas leurs expositions répétées aux gaz, dont les séquelles n’étaient pas ressenties immédiatement. Des années plus tard, aux prises avec diverses maladies et incapacités, ils durent parfois lutter en vain pour faire reconnaître leurs blessures de guerre.
L’horreur causée par cette arme nouvelle conduit la communauté internationale à agir : en 1925, le Protocole de Genève interdit les armes chimiques et biologiques dans les conflits armés.
— Le chlore, une solution qui sauve des vies
Tandis que le chlore semait la mort sur les champs de bataille, un dérivé du même élément allait paradoxalement sauver des milliers de vies dans les hôpitaux militaires.
En 1916, le chimiste anglais Henry Drysdale Dakin et le chirurgien français Alexis Carrel mettent au point une solution antiseptique : la solution de Dakin. Cette préparation à base d’hypochlorite de sodium dilué à 0,5 % (une forme stabilisée d’eau de Javel diluée) s’avère efficace pour nettoyer les plaies de guerre, souvent profondes et contaminées. À une époque où les antibiotiques n’existent pas, les blessures infectées condamnent généralement les soldats à l’amputation ou à la mort par septicémie.
Le procédé Carrel-Dakin consiste à irriguer continuellement les plaies avec cette solution chlorée, à l’aide d’un système ingénieux de tubes et de réservoirs. Cette méthode permet de maintenir un environnement hostile aux microorganismes sans endommager les tissus sains ni retarder la cicatrisation. Les résultats sont inespérés : le taux de mortalité et d’amputation chute drastiquement parmi les blessés traités. Les hôpitaux militaires l’adoptent sur tous les fronts, sauvant ainsi des milliers de combattants. L’efficacité de la solution s’explique par son large spectre d’action contre les bactéries (Gram positif et négatif), les levures, les moisissures, les virus et même les spores.
Plus d’un siècle après sa création, la solution de Dakin demeure un traitement de référence en médecine moderne, particulièrement efficace contre les plaies chroniques, comme les ulcères variqueux ou les escarres. Cette dualité du chlore, à la fois arme mortelle et outil thérapeutique salvateur, illustre bien l’ambivalence des avancées scientifiques, dont l’impact sur l’humanité dépend moins de leur nature que de l’usage qu’on en fait.
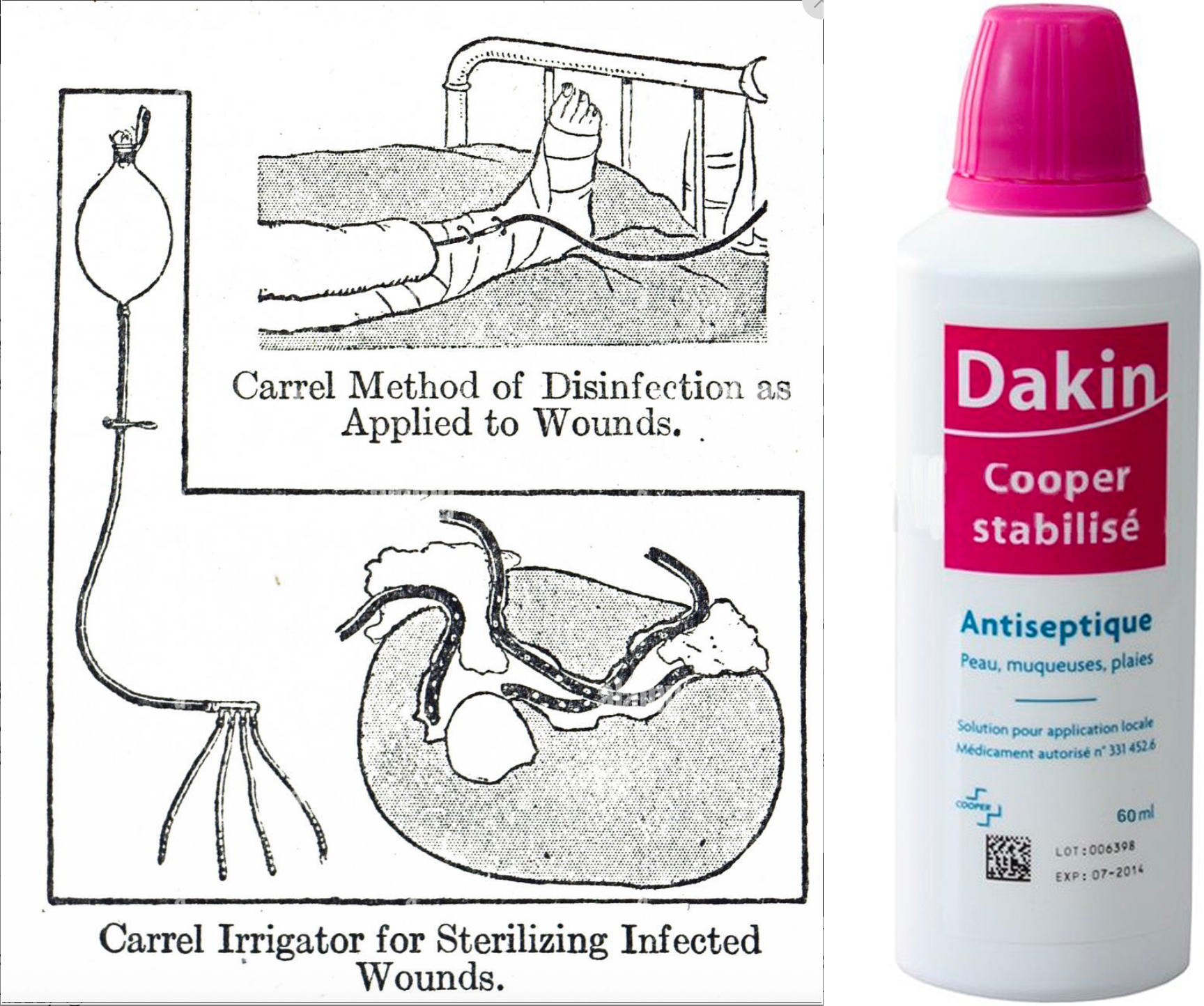
Dessin de la méthode (procédé Carrel-Dakin) utilisant la solution de Dakin, et bouteille de produit pour application locale.
Le chlore au présent
— Le chlore dans l’eau du robinet
En 1908, Jersey City, dans le New Jersey, devient la première ville américaine à traiter son eau potable au chlore. Le contexte est dramatique : depuis des décennies, les nombreux cas de maladies hydriques, principalement la typhoïde et la dysenterie, causent des dizaines de milliers de décès.
En 1899, la ville avait mandaté la Jersey City Water Supply Company pour la construction d’un barrage sur la rivière Rockaway et la création du réservoir Boonton, d’une capacité de plus de sept milliards de gallons. Cependant, malgré cette nouvelle source d’approvisionnement, les problèmes de contamination persistaient.
Le Dr John L. Leal trouve alors une solution innovante. Médecin en santé publique, il est sensible à la cause, marqué par la longue maladie de son père (lui-même médecin militaire) qui avait contracté une dysenterie chronique pendant la guerre de Sécession. Avec l’ingénieur George Warren Fuller, il conçoit un système qui ajoute de la chaux chlorée à l’eau du réservoir Boonton. Les résultats sont immédiats et spectaculaires. Les bactéries disparaissent, les cas de typhoïde s’effondrent. L’expansion rapide de cette technologie témoigne de son efficacité : en 1914, plus de 21 millions d’Américains bénéficieront d’eau chlorée, soit 53 % des approvisionnements publics en eau des États-Unis. Au Canada, elle constitue la norme dans la plupart des réseaux municipaux. En plus de son coût modique et de son efficacité contre les pathogènes courants, le chlore offre l’avantage de laisser un résidu protecteur tout au long du réseau de distribution.
Plus récemment, en 2021, lors d’une conférence de l’Organisation mondiale de la santé, était présentée une méta-analyse qui démontre que le traitement de l’eau, notamment par chloration, permet de réduire de 25 à 32 % la mortalité infantile toutes causes confondues dans les régions où les maladies hydriques sont endémiques. La même année, une étude menée au Kenya confirme les bienfaits de cette mesure sanitaire simple ; l’expérimentation, réalisée dans des villages ruraux, consistait à installer des distributeurs de chlore gratuits à proximité des points d’eau. Sur une durée de quatre ans, les chercheurs ont observé une diminution de 63 % de la mortalité des enfants de moins de cinq ans dans les zones concernées. Le rapport coûts/bénéfices de cette stratégie est exceptionnel : moins de 25 dollars par année de vie sauvée.
Après plus de 100 ans, la chloration de l’eau continue de jouer un rôle déterminant dans la prévention des maladies infectieuses. Elle demeure l’une des interventions les plus rentables et les plus simples pour améliorer la santé des populations — une solution modeste, mais d’une portée incalculable.
— Le chlore dans l’eau de la piscine
« La piscine sent trop le chlore, ils en ont mis beaucoup trop ! » Ce commentaire, fréquent dans les piscines publiques, révèle un malentendu courant. Contrairement à la croyance populaire, l’odeur âcre et piquante n’est pas exactement celle du chlore, mais celle des chloramines — des composés chimiques formés lorsque le chlore réagit avec des matières organiques, comme que la sueur, l’urine ou les résidus de cosmétiques introduits par les baigneurs.
Le chlore dissous dans l’eau est pratiquement inodore. À la rencontre de ces contaminants, il forme des composés tels que la monochloramine (NH₂Cl), la dichloramine (NHCl₂) et la trichloramine (NCl₃). Ces dernières, en se volatilisant, créent cette odeur caractéristique et irritent les yeux, la peau et les voies respiratoires. Paradoxalement, une forte odeur de « chlore » signale non pas un excès, mais une insuffisance de désinfection. Pour limiter la formation de chloramines, les experts recommandent des mesures élémentaires. Pour les gestionnaires de piscines : maintenir des niveaux adéquats de chlore, améliorer la ventilation et installer des systèmes de filtration avancés. Pour les baigneurs : se doucher soigneusement avant d’entrer dans l’eau — une douche de deux minutes élimine la majorité des contaminants — et éviter toute miction dans le bassin — ne pas faire pipi dans l’eau !
Ce quiproquo illustre la subtilité des réactions chimiques. En ce qui concerne le chlore, ce n’est pas l’élément lui-même qui pose problème, mais bien ses interactions complexes avec les différents environnements. Une leçon de chimie qui nous rappelle que, derrière les idées reçues, se cachent souvent des corrélations plus nuancées.
Dans la pharmacie
Le chlore se trouve assurément dans notre armoire à pharmacie : près du quart des médicaments contiennent au moins un atome de chlore dans leur structure moléculaire. Cette présence discrète mais essentielle améliore l’efficacité, la stabilité et l’absorption de nombreux traitements.
Parmi les plus connus, le diazépam contient un atome de chlore stratégiquement placé qui lui confère ses propriétés anxiolytiques. Les antihistaminiques, comme la cétirizine et la loratadine, couramment utilisés contre les allergies saisonnières, doivent leur action prolongée à la présence de chlore dans leur formule. Le diclofénac, anti-inflammatoire prescrit dans le cas de douleurs articulaires, porte même deux atomes de chlore — d’où le préfixe « diclo » dans son nom.
Rassurez-vous : le chlore contenu dans ces médicaments n’a rien à voir avec l’eau de Javel. Chimiquement lié à la molécule, il est parfaitement stable et sécuritaire. Si vous avez des questions concernant vos médicaments, n’hésitez pas à consulter votre pharmacien ou pharmacienne.
L’avenir du chlore
— Le chlore dans l’air
La synthèse des premiers chlorofluorocarbones (CFC) est réalisée par le chimiste belge Frédéric Swarts dans les années 1890. À la fin des années 1920, ces molécules participent à la révolution industrielle, grâce à leurs propriétés remarquables. Ces composés synthétiques, qui contiennent du carbone, du chlore et du fluor, sont ininflammables, non toxiques, chimiquement stables et très efficaces comme réfrigérants. Ils trouvent rapidement leur place dans les réfrigérateurs, les climatiseurs, les bombes aérosol et les solvants, promettant confort et sécurité d’usage. Le Fréon, commercialisé par la Kinetic Chemicals (fondée par General Motors et DuPont), devient synonyme de modernité domestique.
Cependant, cette stabilité chimique qui fait le succès des CFC est leur talon d’Achille environnemental. Une fois libérés dans l’atmosphère, ils s’élèvent lentement vers la stratosphère où, sous l’effet des rayons ultraviolets, ils se décomposent et libèrent des atomes de chlore. Ces derniers entament alors une réaction en chaîne néfaste : un seul atome de chlore peut détruire jusqu’à 100 000 molécules d’ozone (O₃), cette couche protectrice qui nous préserve des rayonnements ultraviolets. Avec une durée de vie dans l’atmosphère de 50 à 100 ans, les effets des CFC se poursuivent plusieurs décennies après leur émission.
L’ampleur du problème se révèle dans les années 1980 avec la découverte du « trou dans la couche d’ozone » au-dessus de l’Antarctique. Les scientifiques britanniques observent une diminution alarmante de 40 % de l’ozone stratosphérique durant le printemps austral. Cette nouvelle consterne le monde entier et mobilise la communauté scientifique internationale.
Face à cette menace planétaire, le Protocole de Montréal est signé le 16 septembre 1987 pour entrer en vigueur le 1er janvier 1989, marquant le début de l’élimination des CFC. Cette coopération internationale, saluée comme l’un des accords environnementaux les plus réussis de l’histoire, est le premier traité des Nations Unies à avoir atteint une ratification universelle, avec 198 parties (197 États et l’Union européenne). L’industrie chimique développe alors des alternatives moins nocives : les HCFC (hydrochlorofluorocarbones), puis les HFC (hydrofluorocarbones), dépourvus de chlore.
Depuis l’interdiction progressive, la couche d’ozone montre des signes de récupération, bien que cette amélioration semble moins rapide depuis les années 2000-2010. Plusieurs facteurs expliquent le ralentissement observé : des émissions non déclarées provenant principalement de l’est de la Chine ; les CFC stockés dans les mousses isolantes et les équipements qui continuent de se libérer ; le réchauffement climatique. Les scientifiques estiment que le couche d’ozone pourrait retrouver son épaisseur d’avant 1980 vers 2060-2070, tout dépendant des cas d’émissions persistantes.

Signature du Protocole de Montréal, 16 septembre 1987
Source : https://cmosarchives.ca/Metphotos/T10/MontrealProtocol1987.html
— Le chlore dans l’espace
En 2008, la sonde Phoenix fait une découverte inattendue sur Mars : des perchlorates (sels de chlore), présents à des concentrations 200 fois supérieures à celles de la Terre. Ces composés chlorés, formés par l’interaction entre l’atmosphère martienne et les rayonnements cosmiques, racontent l’histoire géochimique de Mars. Leur distribution généralisée suggère que les tempêtes de poussière les auraient dispersés à l’échelle planétaire pendant des millions d’années. Confirmée par les astromobiles Curiosity et Perseverance, cette trouvaille transforme notre vision de la planète rouge.
Pour la recherche sur la vie extraterrestre, les perchlorates représentent un casse-tête fascinant. Toxiques pour la plupart des organismes terrestres, ils stérilisent le sol martien. Pourtant, certaines bactéries terrestres, comme les dechloromonas aromatica utilisent ces composés comme source d’énergie. Cette découverte ouvre la porte à l’hypothèse d’une « biochimie alternative » martienne, adaptée à un environnement riche en chlore.
Concernant de futures « missions habitées », elles devront composer avec cette réalité chimique. D’un côté, l’exposition aux perchlorates menace la fonction thyroïdienne des astronautes, nécessitant des technologies de décontamination. De l’autre, ces composés pourraient offrir des possibilités surprenantes : la production d’oxygène respirable par leur décomposition, ou de carburant pour le voyage retour, grâce à leur pouvoir oxydant.
En conclusion, le chlore est l’élément du paradoxe.
Mélanger de l’eau de Javel avec des produits acides (comme le vinaigre ou certains détartrants) libère instantanément du chlore gazeux et dans une salle de bain mal ventilée, les concentrations peuvent devenir mortelles. Jumelé au sodium, le chlore contribue à maintenir le pH sanguin dans une fourchette étroite compatible avec la vie.
Cet élément du groupe des halogènes ne peut être qualifié de bon ou de mauvais, de dangereux ou de bénéfique, sans voir poindre son contraire. Tout dépend d’où il se trouve, dans quelles conditions, avec quels compagnons. Mais surtout, ce qu’on en fait.













