Source : DALL.E et Photoshop
Introduction
L’azote est l’élément chimique numéro 7, au symbole N, dans le tableau périodique. Il appartient à la famille des non-métaux. Dans sa forme gazeuse, il est sans couleur, sans odeur et considéré inerte — il ne réagit pas, sauf dans des conditions extrêmes. L’azote liquide ressemble à l’eau, aussi incolore et inodore, mais il est très froid — son point d’ébullition se trouve à -196 °C.
Cette série présente les éléments du Tableau périodique des éléments chimiques. Ce répertoire, conçu vers 1869 par Dmitri Ivanovich Mendeleïev, rassemble tous les éléments chimiques, qui composent l’univers, tel que nous le connaissons aujourd’hui. L’ingéniosité de ce Tableau tient dans la méthode de répartition des éléments, selon leur numéro atomique, mais aussi selon leurs caractéristiques physiques et chimiques. Ce classement astucieux permet alors d’identifier des éléments existants qui restaient à découvrir, ou même de prédire les propriétés d’éléments chimiques inconnus à l’époque. Sa dernière mise à jour date de 2016, et compte 118 éléments.
Formant environ 78 % de l’atmosphère terrestre, l’azote est le principal élément de l’air que nous respirons. De plus, en tant que composant essentiel des acides aminés et des protéines, il joue un rôle fondamental dans la vie.
Par ses caractéristiques uniques, l’azote est utilisé dans plusieurs domaines, de l’agriculture à la technologie de pointe. Entre autres, il permet de créer des milieux inertes, indispensables dans la fabrication de pièces électronique, par exemple, ou pour la préservation des aliments. On lui trouve des usages en aérospatiale, dans la production d’explosifs, de plastiques, ou de colorants. L’azote liquide sert en médecine, pour la cryochirurgie ou la conservation des cellules, et en gastronomie, dans la cuisine moléculaire. Les composés de l’azote, tels que les nitrates et les ammoniacs, sont des constituants clés des engrais agricoles.
Malgré sa prévalence et son importance, il a fallu des siècles pour pleinement comprendre et exploiter ses propriétés.
Le passé de l’azote
— Les multiples noms de l’azote
Les composés de l’azote sont de notoriété ancienne ! Le chlorure d’ammonium était connu d’Hérodote (né vers 484 av. notre ère), et les alchimistes (12e – 16e siècle) utilisaient l’acide nitrique sous le nom d’aqua fortis (eau-forte).
La découverte « officielle » de l’azote en tant qu’élément est attribuée au chimiste écossais Daniel Rutherford, en 1772. Rutherford menait des expériences sur l’air avec une souris placée sous une cloche de verre. Il a observé que la souris ne pouvait pas survivre, dans un « air » dépourvu d’oxygène. En brûlant du phosphore, il a retiré l’oxygène de l’air, puis il a isolé le gaz restant. Il a appelé ce gaz noxious air (air infect ou poison).
À cette époque, la théorie du phlogistique croyait que le feu était caché à l’intérieur de toutes choses pouvant brûler. Selon cette thèse, une substance intrinsèque à toute matière inflammable s’échapperait lors de la combustion sous la forme de « phlogistons ». Le gaz inerte de Rutherford était considéré comme un « air phlogistiqué », qui aurait absorbé tous les « phlogistons », raison pour laquelle il devenait irrespirable.
En 1787, le chimiste français Antoine Lavoisier propose le nom « azote », du mot grec « azotos » (sans vie) puisqu’il ne peut soutenir la vie — en contraste avec l’oxygène.
Vers 1794, le mot anglais nitrogen apparaît, du français « nitrogène » — nitro (nitre) et gène (engendrer). Le nitre (ou salpêtre) est une matière explosive. Le chimiste français Jean-Antoine Chaptal croit que le terme décrit mieux cet air corrompu et impropre à la respiration. Selon lui, l’appellation « azote » est inadéquate, puisque la plupart des gaz — sauf l’oxygène, s’avèrent « invivables ».
Encore aujourd’hui, les noms de l’élément N ont des significations différentes en anglais ou en français, et en allemand ; le mot stickstoff veut dire « substance étouffante ».
— Deux origines de l’azote sur la terre
Théorie 1. L’azote entre en scène dès les premiers instants de notre planète
Il y a environ 4,6 milliards d’années, la Terre se forme à partir des gaz et des poussières entourant le Soleil. Au cours de ces collisions entre divers objets célestes, l’azote — entre autres — est piégé dans la croûte terrestre et le manteau de la Terre, sous des températures extrêmes.
Au fil des millions d’années, la Terre refroidit et les gaz commencent à s’échapper de la croûte terrestre — un processus connu sous le nom de dégazage. Une grande période d’éruptions volcaniques permet à l’azote, au dioxyde de carbone, à de la vapeur d’eau et autres gaz de se libérer pour former la première atmosphère de la Terre, ainsi que les océans primitifs, il y a environ 3,8 milliards d’années.
Théorie 2. L’azote terrestre proviendrait en partie de comètes
Des chercheurs ont observé que l’azote terrestre et celui trouvé dans certaines comètes partagent des similitudes qui pourraient indiquer une origine commune. Lors du Grand bombardement tardif (4,1 à 3,8 milliards d’années), les comètes et autres objets extraterrestres, en s’écrasant sur la jeune Terre, auraient apporté avec eux de l’azote, ainsi que d’autres gaz et éléments essentiels au développement de la vie.
Le processus de transformation de l’azote gazeux en composés assimilables par le vivant sera déterminant dans l’évolution biologique, permettant à la vie de se diversifier et de se complexifier.
L’azote au présent
— Le cycle de l’azote
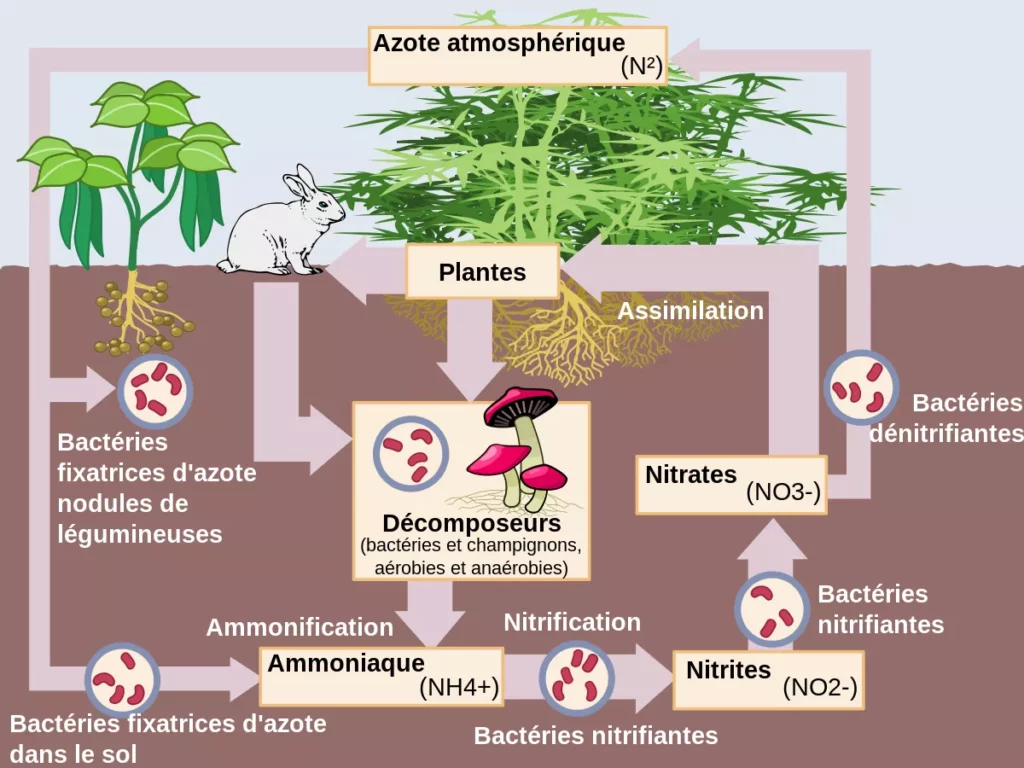
Le cycle de l’azote est un processus biogéochimique par lequel l’azote est converti en différentes formes dans l’environnement. L’intervention humaine a un impact significatif sur le cycle de l’azote (voir plus bas : L’azote dans l’avenir), et chaque écosystème possède ses variations. Les étapes qui suivent résument le cycle de l’azote dans son ensemble.
Fixation de l’azote : Certaines bactéries prennent l’azote de l’air et le convertissent en une forme que les plantes peuvent assimiler — principalement de l’ammoniac. La foudre y contribue, en générant des nitrates emportés dans le sol par la pluie.
Nitrification : L’ammoniac est converti en nitrites, puis en nitrates par d’autres bactéries.
Assimilation : Les plantes absorbent ces nitrates du sol pour fabriquer des protéines et de l’ADN.
Décomposition : Quand les plantes et les animaux meurent, des champignons et des bactéries décomposent leur matière et la transforment en ammonium.
Dénitrification : Toujours grâce aux bactéries, l’ammonium est converti en azote gazeux, qui retourne dans l’atmosphère. Le cycle est complété.
Source : Wikipedia
— Le gazon coupé comme engrais azoté
L’utilisation des coupes de gazon peut offrir plusieurs avantages en remplacement d’autres formes d’engrais, surtout chimiques. Cette pratique écologique simplifie le travail au jardin et l’enrichit de manière naturelle.
Si l’herbe n’est pas trop haute, on laisse le résultat de la tonte au sol. Le gazon fraîchement coupé fertilise la pelouse en libérant, notamment, de l’azote, du phosphore et du potassium. Cette méthode offre en outre une couverture protectrice contre l’érosion et la sécheresse, pour un gazon encore plus vert. Au Québec, les municipalités sont encouragées à promouvoir l’herbicyclage.
L’herbe coupée peut aussi servir de paillis au pied des arbres, des arbustes et des plantes. Au compost, c’est de la matière (résidus) verte, qui apporte azote et humidité au mélange.
L’azote dans l’avenir
— Les déchets azotés
Bien qu’essentiel à toute vie, l’azote peut devenir toxique s’il se retrouve en excès. Les excréments des animaux, les déchets humains et les résidus de l’industrie alimentaire contiennent tous de l’azote. Si la nature — ou un écosystème — n’a pas le temps de décomposer ses déchets, le cycle de l’azote en est déséquilibré.
Par exemple, l’utilisation abusive d’engrais azotés en agriculture peut entraîner une contamination des eaux souterraines et de surface, puis conduire — tout comme le phosphore — à l’eutrophisation des lacs et rivières. Ce phénomène engendre une croissance excessive d’algues, qui, en consommant tout l’oxygène de l’eau, étouffe les autres formes de vie aquatique.
Dans le but de rétablir un équilibre environnemental, une meilleure gestion de l’azote devient nécessaire. Des principes de permaculture refont surface, comme l’utilisation de légumineuses en tant que fixateur d’azote (engrais) naturel. Pour une fertilisation plus précise, l’intelligence artificielle est mise à contribution. Et grâce à la combinaison des technologies de filtration et de certains processus biologiques, de nouvelles méthodes de récupération de l’azote provenant des eaux usées sont explorées.
— Le gaz d’oxyde nitreux
L’oxyde nitreux, ou protoxyde d’azote, est mieux connu sous le nom de « gaz hilarant ». Grâce à ses propriétés anesthésiques, il est très utile en chirurgie et en dentisterie. Cependant, son usage en tant que drogue récréative peut s’avérer dangereux. Répandu dans les événements festifs et promu par certains influenceurs, ce gaz euphorisant est en popularité croissante auprès des jeunes. Cet engouement inquiète certains organismes et professionnels de la santé. Les risques encourus, même lors d’une première utilisation, ont des conséquences potentielles graves telles des brûlures, l’asphyxie, la psychose ou d’autres troubles neurologiques.
Au Canada, on le trouve en vente libre, d’accès facile et au coût relativement bas. Certains pays d’Europe en interdisent déjà la vente aux mineurs, ou y songent sérieusement.
À noter que l’oxyde nitreux est un gaz à effet de serre environ 300 fois plus puissant que le dioxyde de carbone. Ses effets sont d’autant plus préoccupants qu’il contribue également à la destruction de la couche d’ozone. Comme avec les déchets azotés, des efforts sont déployés afin de réduire ses émissions dans l’atmosphère, de manière à exploiter de façon responsable ses avantages médicaux tout en atténuant son impact environnemental négatif.
Dans la pharmacie
Le monoxyde d’azote (NO), longtemps considéré comme un simple polluant, tient en réalité un rôle crucial dans la distribution du sang dans notre corps. Cette révélation surprenante et plutôt récente a révolutionné notre compréhension des mécanismes cardio-vasculaires. Le monoxyde d’azote s’est aussi avéré incontournable dans plusieurs fonctions vitales, tels le système immunitaire, l’odorat ou la mémoire.
Les artisans de cette remarquable découverte, les pharmacologistes américains Robert Furchgott, Louis Ignarro et Ferid Murad, ont d’ailleurs reçu le prix Nobel de médecine pour leurs travaux, en 1998. Grâce à eux, de nouveaux médicaments ont pu être développés, traitant des conditions allant de l’artériosclérose à l’angine. La plus populaire de ces formules innovantes est le sildénafil ; initialement exploré pour soigner les maladies cardiaques, il sert en fait à d’autres affaires du cœur 💙…
Vous aurez reconnu… le Viagra (C22H30N6O4S) !













